「メッキの仕組みが知りたい」
「具体的にどういう方法でめっきしているんだろう」
このような疑問を解決します。
こんにちは。機械設計エンジニアのはくです。
2019年に機械系の大学院を卒業し、現在はメーカーで機械設計エンジニアとして働いています。
本記事では、めっき学習の第2ステップとして「めっきの仕組みと分類」を解説します。
この記事を読むとわかること。
- めっきの仕組みと手法がわかる
- 乾式めっきと湿式めっきの違いがわかる
- 電気めっきと無電解めっきの違いがわかる
- めっきしやすい金属・めっきしにくい金属の違いがわかる
めっきの方法は、水溶液を使わない乾式めっきと、水溶液を使う湿式めっきの2種類。
前者は半導体製造でよく使われるPVDやCVDなどの真空めっきと、トタンやブリキの製造に使われる溶融めっきがあります。
一方、湿式めっきは、水溶液を使って金属の酸化・還元反応を利用するめっき法。
電気を使う電気めっきと、電気を使わない無電解めっきの2種類があります。
今回は、この電気めっきと無電解めっきについて詳しく解説します。
イラスト付きでわかりやすく説明するので、ぜひ参考にしてください。
めっき方法の分類
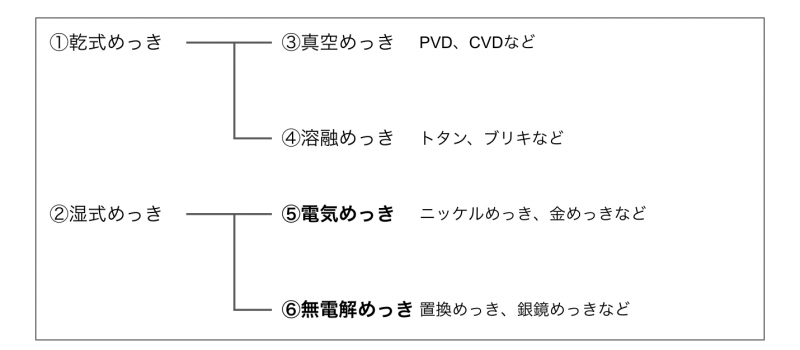
さきほど言ったように、めっきはその仕組みによって分類されます。
図で表すと上記のとおり。
簡単に説明すると、①乾式めっきは水溶液を使わないめっき方法で、③真空めっきと④溶融めっきの2種類にわかれます。
③真空めっきは、真空(大気圧より低い圧力)で金属・無機化合物・有機物の薄膜をつくる方法のこと。
僕が働く半導体製造でよく使われる方法ですが、電気めっきと比べてコストが高く量産性が低いというデメリットもあります。
また、④溶融めっきは、亜鉛やアルミニウムなどの融点が低い金属を溶解させてめっきする方法です。
鉄板に亜鉛合金を被覆したトタン、スズを被覆したブリキが代表例。
面積の大きいものや重量物のめっきに適しています。
一方の②湿式めっきは、水溶液を使って金属の酸化・還元反応を利用する方法です。
電気を使う⑤電気めっきと、電気を使わない⑥無電解めっきの2種類があります。
こちらは以下で詳しく解説していきます。
電気めっきの仕組み
電気めっきは、水溶液の電気分解を利用してめっきする手法です。
具体的な工程は次のとおり。
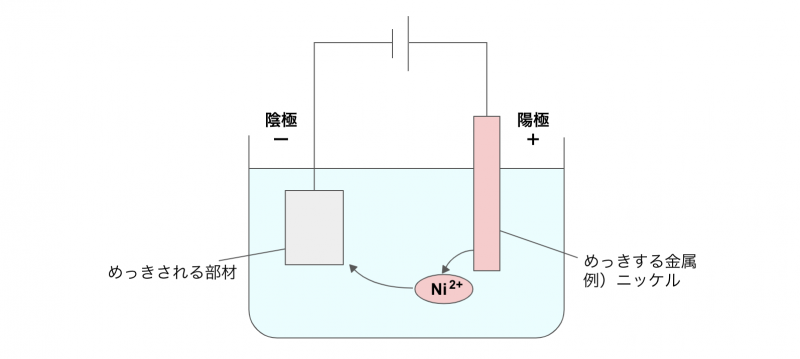
まず、めっきする金属を陽極、めっきしたい部材を陰極にセットします。
この回路に電気を流すと、陽極ではめっきする金属が溶け出して、水溶液中に金属イオンを供給します(酸化反応)。
陰極では、溶け出した金属イオンが電子を受け取り、金属原子となります(還元反応)。
析出した金属原子は、皮膜として陰極の部材にめっきされるという仕組みです。
ニッケルめっきを例に挙げると、陽極・陰極で起きる反応はそれぞれ以下のとおりになります。
(陽極)Ni → Ni2+ + 2e
(陰極)Ni2+ + 2e- → Ni
電気めっきの注意点
電気めっきでは、どれくらい電流を流すとどれくらいめっきできるかがファラデーの電気分解の法則によって決まります。
- 電気分解によって析出する物質の量は、流れた電気量(電流の強さと時間)に比例する
- 1グラム当量の物質を析出するための電気量は、物質の種類によらず一定
ここで電気量とは、電流の強さと流した時間のこと。
また、1グラム当量というのは化学反応における基本量のことで、原子量を原子価で割って求められます。
たとえば、酸素は原子価が2、原子量が16なので、1グラム当量は8g。
ファラデーの電気分解の法則から析出量が求められ、単位面積あたりの析出量を密度で割るとめっき厚さが求まります。
(ただし、これは理論値であり、実際にはめっき金属やめっき浴の種類、電流効率などを考慮する必要があります。)
電気めっきでは、電流が強すぎると皮膜形成スピードが速くなりすぎて、粗いめっきになってしまいます。
また、金属イオンの供給が遅れると、水の電気分解が起きてしまい、水素が発生します。
水素が発生すると、溶液中にはアルカリイオンOH-が残るため、pHが上昇して「焦げ」の原因となってしまいます。
これでは良質なめっきが得られないため、電気めっきではめっき品の形状や面積に対して、適正な電流の強さ・時間の管理が重要になります。
無電解めっきの仕組み
無電解めっきは、電気を使わずに、酸化反応によって供給される電子を使うめっき法です。
酸化還元反応の種類によって、置換めっき、銀鏡めっき、自己触媒作用によるめっきなどの種類があります。
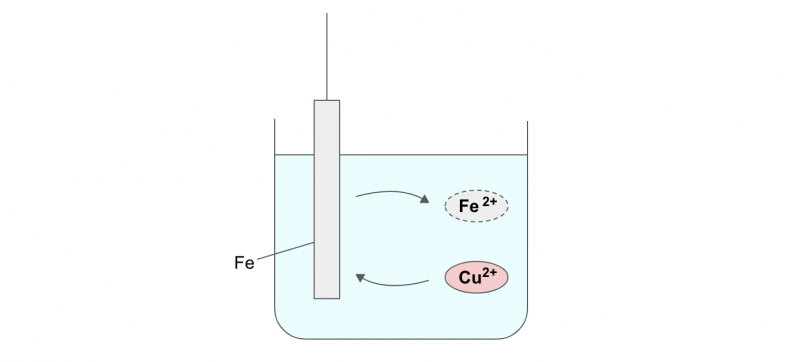
置換めっき
置換めっきは、めっきする金属と部材のイオン化傾向の差を利用する方法です。
たとえば、硫酸銅(Cu2+)の溶液に鉄(Fe)を浸せきすると、イオン化傾向の大きい鉄が溶け出して電子を放出します(酸化反応)。
溶液中では、放出された電子が銅イオンCu2+を還元して、鉄板上に銅がめっきされるという仕組みです。
銀鏡めっき
銀鏡めっきは、還元剤の酸化反応を利用してめっきする方法です。
ガラスなどの非電導性素材に、電導性皮膜をつくる方法として用いられます。
自己触媒作用によるめっき
自己触媒作用とは、反応物自身が反応を促進するための触媒となる作用のことです。
ニッケルや銅にはこの自己触媒作用があるため、還元剤を用いることで触媒となってめっき反応を促します。
反応時間に比例してめっきが進むため、厚付けめっきが可能です。
めっきできる金属・できない金属
さいごに、今回解説した湿式めっきができる金属・できない金属について解説します。
湿式めっきが可能かどうかは、ずばり①イオン化傾向と②水溶液中での金属イオンの形態によって決まります。
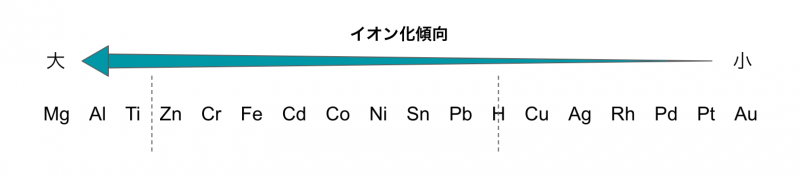
ここまで説明してきたとおり、めっきは金属イオンに電子を与えて金属に還元する方法です。
したがって、イオン化しやすい金属をめっきするためにはより大きなエネルギーが必要で、イオン化傾向が大きくなるとめっきできなくなります。
具体的には、亜鉛までがめっきできる金属で、それよりイオン化傾向が大きいチタンやアルミニウム、マグネシウム、カルシウムなどは水溶液からはめっきできません。
また、イオンになりやすい金属は、それだけ反応しやすいということでもあります。
このような金属イオンは、大気中では酸素と結合して安定な酸化物として存在していることが多いです。
水溶液中でも酸化物イオンとして安定しているため、電気エネルギーを与えても酸化物イオンから金属イオンを引き離しにくくなります。
ただし、単一金属としてめっきできなくても、合金めっきなら可能な場合もあります。
たとえば、タングステンはイオン化傾向が大きいですが、ニッケル-タングステン合金めっきとして耐摩耗性や耐熱性の向上に使われたりします。
- イオン化傾向が小さい金属 = めっきしやすい
- イオン化傾向が大きい金属 = めっきしにくい・できない
金属の物性とめっき条件
めっきは化学反応なので、温度が高いほど反応速度が速くなります。
したがって、一般的には、ニッケルやクロムのように融点が高く硬い金属の方がめっき速度が速く、微細な皮膜がつくれます。
反対に、亜鉛やスズのように融点が低く柔らかい金属は、高温でめっき反応が加速されると、粗いめっきになってしまいます。
また、前回の記事で解説したように、めっきには装飾性を良くする以外に、機能性を向上させる目的があります。
たとえば、融点の高いニッケルやクロムは耐熱性向上に使われますし、低融点のスズや鉛の合金ははんだなどの接合用めっきとして使われます。
金属の電気伝導度は銀・銅・金の順で高く、これらは電気を流す電子部品の接点へのめっきに使われます。
まとめ:湿式めっきは金属の酸化・還元反応を利用するめっき法!

記事の内容をまとめます。
- めっきの仕組みは乾式めっきと湿式めっきの2種類
- 乾式めっきは真空で薄膜を形成する真空めっきと、金属を溶解させてめっきする溶融めっきの2種類
- 湿式めっきは、電気を使う電気めっきと、電気を使わない無電解めっきの2種類
- 電気めっきでは、めっきする金属を陽極、めっきしたい部材を陰極に用いて電流を流す
- めっき厚のコントロールには、適正な電流の強さ・時間の管理が重要
- 無電解めっきは、電気を使わず酸化反応によって供給される電子を使う方法
- イオン化傾向の差を利用する置換めっき、還元剤を利用する銀鏡めっき、自己触媒作用を利用するめっきなどがある
- 湿式めっきが可能な金属は、イオン化傾向が小さい金属
- イオン化傾向が大きい金属は、合金めっきとしてめっきできる場合がある
以上です。
今回は、めっきの中でも湿式めっきに分類される電気めっきと無電解めっきについて解説しました。
湿式めっきは、金属の酸化還元反応を利用する方法なので、化学反応やイオン化傾向などの知識が必要です。
今回の記事を読んで興味を持った方は、ぜひ自分でも勉強してみると理解が深まりますよ!




コメント